Catatan War
Berbagi bersama tentang Kimia
7 Jul 2010
Eugenol
30 Nov 2009
Gugus Fungsi
Gugus fungsi merupakan bagian yang aktif dari suatu senyawa karbon. Apabila senyawa karbon yang memiliki gugus fungsi bereaksi dengan suatu zat, maka gugus fungsi itu akan mengalami perubahan, sedangkan bagian yang lain umumnya tetap. Berdasarkan gugus fungsi yang dimilikinya, senyawa-senyawa karbon dikelompokkan kedalam kelompok alkohol, eter, aldehid, keton, asam karboksilat, ester.
| Gugus | Nama Gugus | Terdapat pada Senyawa | Contoh | |
| -OH -O- -CHO -CO -COOH -COO- |
| Alcohol Alkoksi alkana Alkanal Alkanon Asam alkanoat Ester | C 2 H 5 OH C 2 H 5 -O- C 2 H 5 CH 3 -CHO CH 3 -CO- CH 3 C 2 H 5 -COOH C 2 H 5 -COOC 2 H 5 |
ALKOHOL
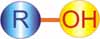
Alkohol merupakan kelompok senyawa karbon yang memiliki gugus fungsi hidroksil (-OH) dengan rumus umum R-OH atau CnH2n+1OH. Senyawa ini mempunyai nama IUPAC alkanol karena dianggap sebagai urutan alkana dengan mensubstitusi satu atom H dengan gugus –OH.
ETER
Eter atau nama resminya berdasarkan aturan IUPAC alkoksi alkana, yang dianggap sebagai turunan alkana, mempunyai rumus umum R-O-R' atau CnH2n+2O. Bila R=R' disebut eter sederhana, sedangkan bila R bukan R' disebut eter majemuk.
ALDEHID
Aldehid termasuk senyawa karbonil (-C=O). Aldehid merupakan singkatan dari alkohol dehidrogenatus. Senyawa ini dianggap turunan dari alkana sehingga disebut alkanal dan mempunyai rumus umum CnH2nO.Aldehid dapat diperoleh dengan jalan oksidasi alkohol primer
KETON
Keton atau alkanon termasuk senyawa karbonil (-C=O). Senyawa ini dianggap turunan dari alkana sehingga disebut alkanal dan mempunyai rumus umum CnH2nO. Seperti halnya eter, R yang sama dengan R' disebut katon sederhana, sedangkan R yang tidak sama dengan R' disebut keton majemuk.
ASAM KARBOKSILAT
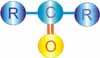
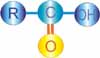
Asam karboksilat atau Alkanoat memiliki rumus umum CnH2nO2 atau R-COOH. Gugus karboksilat (-COOH) merupakan gabungan dari gugus karbonil dan hidroksil. Senyawa ini dianggap turunan alkana dan diberi nama asam alkanoat atau dengan nama yang lebih lama, asam alkana karboksilat.
ESTER
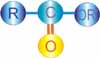
Golongan Ester memiliki rumus umum CnH2nO2 atau R-COO-R'. Nama IUPAC dari ester adalah alkyl alkanoat. Kebanyakan senyawa ester berbau harum, karena itu banyak digunakan sebagai pengharum (esens). Ester dibuat dari asam dan alkohol melalui reaksi esterifikasi yang berupa reaksi setimbang.
Atom, molekul dan ion
Jika suatu unsur, misalnya sepotong besi, dipotong menjadi dua dan potongan tersebut dipotong lagi secara terus-menerus, maka akan diperoleh partikel besi terkecil yang masih mempunyai sifat yang sama seperti sebelum dipotong. Partikel terkecil tersebut dinamakan atom besi.
Jadi unsur besi tersusun dari atom besi. Unsur lain, misalnya emas, juga tersusun dari atom-atom emas. Atom penyusun emas mempunyai sifat yang berbeda dengan atom penyusun besi. Gambar 1 menunjukkan kumpulan atom-atom.

Gambar 1. Kumpulan atom-atom
Pengertian atom merupakan partikel terkecil yang tidak dapat dipecah lagi, pertama kali dikemukakan oleh seorang ahli filsafat Yunani Leukippos dan Deumokritus yang hidup pada abad ke-4 sebelum Masehi (400 – 370 SM). Pada masa itu terdapat pendapat lain yang dikemukakan oleh Aristoteles (384 – 332 SM) bahwa materi dapat dibagi terus-menerus tanpa batas. Pada saat itu pendapat Aristoteles lebih banyak mendapat dukungan sedangkan pendapat Leukippos dan Deumokritus semakin dilupakan.
Pada abad ke-18 ternyata banyak ahli kimia yang dapat menerima pendapat Leukippos dan Deumokritus. Pada tahun 1803, John Dalton, seorang guru sekolah dari Inggris yang ahli dalam bidang fisika dan kimia, mengajukan suatu teori yang menyatakan bahwa materi terdiri atas atomatom.
Teori atom Dalton ini dapat disimpulkan sebagai berikut:
1. Setiap materi tersusun atas partikel terkecil yang disebut atom.
2. Atom tidak dapat dipecah lagi menjadi partikel yang lebih kecil dengan sifat yang sama.
3. Atom-atom dari unsur tertentu mempunyai sifat dan massa yang identik. Unsur-unsur yang berbeda memiliki atom-atom yang massanya berbeda.
4. Senyawa terbentuk dari dua macam atom atau lebih yang berbeda.
5. Reaksi kimia merupakan penggabungan dan pemisahan atom-atom dari unsur atau senyawa dalam reaksi tersebut.
Molekul
Molekul merupakan partikel terkecil dari suatu senyawa. Molekul tersusun dari dua atom atau lebih. Molekul umumnya tersusun dari atom-atom yang berbeda, tetapi beberapa molekul tersusun dari atom-atom yang sama. Molekul yang tersusun dari atom-atom yang berbeda dinamakan molekul senyawa, misalnya molekul air. Tiap satu molekul air tersusun dari satu atom oksigen dan dua atom hidrogen. Sedangkan molekul yang tersusun dari atom yang sama dinamakan molekul unsur, misalnya oksigen. Tiap satu molekul oksigen tersusun dari dua atom oksigen. Gambar 2 menunjukkan molekul oksigen dan molekul air.
molekul oksigen, molekul air

Ion
Jika gula dilarutkan dalam air akan terurai menjadi molekul-molekul gula. Tidak semua senyawa tersusun dari molekul, beberapa senyawa tersusun dari ion-ion. Ion adalah suatu atom atau kumpulan atom yang bermuatan listrik. Suatu senyawa yang terusun dari ion-ion dinamakan senyawa ion. Suatu senyawa ion tersusun dari ion positif (kation) dan ion negatif (anion). Jika garam dapur dilarutkan dalam air, maka akan terurai menjadi ion positif dan ion negatif (gambar 3). Garam dapur merupakan contoh senyawa ion.
ion positif, ion negatif, natrium kloridaGambar 3. Jika natrium klorida dilarutkan dalam air akan terurai menjadi ion positif (ion natrium) dan ion negatif (ion klorida)

Konfigurasi Elektron yang Stabil
 Gambar 1. Struktur Elektron Helium, Neon, dan Argon
Gambar 1. Struktur Elektron Helium, Neon, dan ArgonKecuali helium yang memiliki 2 elektron (duplet), semua gas mulia memiliki 8 elektron (oktet) pada kulit terluarnya. Susunan yang demikian menurut Kossel dan Lewis sangat stabil, sehingga atom-atom gas mulia tidak menerima elektron ataupun melepaskan elektron terluarnya. Hal inilah yang menyebabkan mengapa gas mulia sangat stabil.
 Atom-atom lain agar stabil berusaha memiliki konfigurasi elektron seperti gas mulia. Kecenderungan ini bisa terjadi dengan membentuk ikatan kimia antar atom yang satu dengan atom lainnya. Cara untuk mencapai hal itu adalah:
Atom-atom lain agar stabil berusaha memiliki konfigurasi elektron seperti gas mulia. Kecenderungan ini bisa terjadi dengan membentuk ikatan kimia antar atom yang satu dengan atom lainnya. Cara untuk mencapai hal itu adalah:a. Melepaskan elektron terluarnya sehingga terjadi ion positif (kation).
Misalnya, atom Na yang tidak stabil melepaskan satu elektron valensinya menjadi ion Na+ dengan konfigurasi elektron seperti neon.
 Gambar 2. Perubahan Struktur Elektron Atom Na menjadi Ion Na+
Gambar 2. Perubahan Struktur Elektron Atom Na menjadi Ion Na+b. Menerima tambahan elektron dari atom lain sehingga terjadi ion negatif (anion).
Misalnya, atom Cl yang tidak stabil menerima tambahan satu elektron, sehingga menjadi ion Cl- dengan konfigurasi elektron seperti argon.
 Gambar 3. Perubahan Struktur Elektron Atom Cl menjadi Ion Cl-
Gambar 3. Perubahan Struktur Elektron Atom Cl menjadi Ion Cl-Serah terima elektron yang terjadi dari penggabungan kedua cara di atas disebut ikatan ion.
c. Menggunakan pasangan elektron secara bersama-sama oleh atomatom yang berikatan.
Atom 17Cl (2. 8. 7) yang tidak stabil bisa menjadi stabil dengan cara menggunakan bersama satu pasang elekltron dengan atom klor yang lain sehingga terbentuk molekul fluor, F2. Dengan demikian masing-masing atom akan memiliki konfigurasi elektron yang stabil seperti gas mulia argon (2. 8. 8). Pembentukan molekul dengan cara ketiga ini disebut ikatan kovalen.
 Gambar 4. Perubahan Struktur Elektron Atom Cl menjadi Molekul Cl2
Gambar 4. Perubahan Struktur Elektron Atom Cl menjadi Molekul Cl2Komposisi Zat Dalam Minyak Bumi
Parafin memiliki titik didih lebih dari 240oF. Alpalten merupakan struktur benzen bermuatan, memiliki densitas yang tinggi, membentuk molekul amorf (biasanya padatan britle/getas). Parafin dapat meleleh sedangkan asphalten terdekomposisi, Deposit keduanya mengambang di air dan larut di air.
Parafin larut dalam heptane dan crude oil sedangkan aspalten tidak. Sebagian besar yang ditulisnya adalah benar, tapi ada beberapa hal yang mungkin perlu diluruskan. Jadi yang namanya minyak bumi atau sering juga disebut crude oil adalah merupakan campuran dari ratusan jenis hidrokarbon dari rentang yang paling kecil, seperti metan, yang memiliki satu atom karbon sampai dengan jenis hidrokarbon yang paling besar yang mengandung 200 atom karbon bahkan lebih.
Secara garis besar minyak bumi dikelompokkan berdasarkan komposisi kimianya menjadi empat jenis, yaitu :
1. Parafin
2. Olefin
3. Naften
4. Aromat
Tetapi karena di alam bisa dikatakan tidak pernah ditemukan minnyak bumi dalam bentuk olefin, maka minyak bumi kemudian dikelompokkan menjadi tiga jenis saja, yaitu Parafin, Naften dan Aromat.
Kandungan utama dari campuran hidrokarbon ini adalah parafin atau senyawa isomernya. Isomer sendiri adalah bentuk lain dari suatu senyawa hidrokarbon yang memiliki rumus kimia yang sama. Misal pada normal-butana pada gambar berikut memiliki isomer 2-metil propana, atau kadang disebut juga iso-butana. Keduanya memiliki rumus kimia yang sama, yaitu C4H10 tetapi memiliki rumus bangun yang berbeda seperti tampak pada gambar.
Jika atom karon (C) dinotasikan sebagai bola berwarna hitam dan atom hidrogen (H) dinotasikan sebagai bola berwarna merah. Senyawa hidrokarbon ‘normal’ sering juga disebut sebagai senyawa hidrokarbon rantai lurus, sedangkan senyawa isomernya atau ‘iso’ sering juga disebut sebagai senyawa hidrokarbon rantai cabang. Keduanya merupakan jenis minyak bumi jenis parafin. Sedangkan sisa kandungan hidrokarbon lainnya dalam minyak bumi adalah senyawa sikloparafin yang disebut juga naften dan/atau senyawa aromat. Berikut adalah contoh dari sikloparafin dan aromat
“Keluarga hidrokarbon” tersebut diatas disebut homologis, karena sebagian besar kandungan yang ada dalam minyak bumi tersebut dapat dipisahkan kedalam beberapa jenis kemurnian untuk keperluan komersial. Secara umum, di dalam kilang minyak bumi, pemisahan perbandingan kemurnian dilakukan terhadap hidrokarbon yang memiliki kandungan karbon yang lebih kecil dari C7. Pada umumnya kandungan tersebut dapat dipisahkan dan diidentifikasi, tetapi hanya untuk keperluan di laboratorium.
Campuran siklo parafin dan aromat dalam rantai hidrokarbon panjang dalam minyak bumi membuat minyak bumi tersebut digolongkan menjadi minyak bumi jenis aspaltin. Minyak bumi di alam tidak pernah terdapat dalam bentuk parafin murni maupun aspaltin murni, tetapi selalu dalam bentuk campuran antara parafin dan aspaltin.
Pengelompokan minyak bumi menjadi minyak bumi jenis parafin dan minyak bumi jenis aspaltin berdasarkan banyak atau dominasi minyak parafin atau aspaltin dalam minyak bumi. Artinya minyak bumi dikatakan jenis parafin jika senyawa parafinnya lebih dominan dibandingkan aromat dan/atau siklo parafinnya. Begitu juga sebaliknya.
Dalam skala industri, produk dari minyak bumi dikelompokkan berdasarkan rentang titik didihnya, atau berdasarkan trayek titik didihnya. Pengelompokan produk berdasarkan titik didih ini lebih sering dilakukan dibandingkan pengelompokan berdasarkan komposisinya.. Minyak bumi tidak seluruhnya terdiri dari hidrokarbon murni.
Dalam minyak bumi terdapat juga zat pengotor (impurities) berupa sulfur (belerang), nitrogen dan logam. Pada umumnya zat pengotor yang banyak terdapat dalam minyak bumi adalah senyawa sulfur organik yang disebut merkaptan. Merkaptan ini mirip dengan hidrokarbon pada umumnya, tetapi ada penambahan satu atau lebih atom sulfur dalam molekulnya.
Senyawa sulfur yang lebih kompleks dalam minyak bumi terdapat dalam bentuk tiofen dan disulfida. Tiofen dan disulfida ini banyak terdapat dalam rantai hidrokarbon panjang atau pada produk distilat pertengahan (middle distillate). Selain itu zat pengotor lainnya yang terdapat dalam minyak bumi adalah berupa senyawa halogen organik, terutama klorida, dan logam organik, yaitu natrium (Na), Vanadium (V) dan nikel (Ni).
Titik didih minyak bumi parafin dan aspaltin tidak dapat ditentukan secara pasti, karena sangat bervariasi, tergantung bagaimana komposisi jumlah dari rantai hidrokarbonnya. Jika minyak bumi tersebut banyak mengandung hidrokarbon rantai pendek dimana memiliki jumlah atom karbon lebih sedikit maka titik didihnya lebih rendah, sedangkan jika memiliki hidrokarbon rantai panjang dimana memiliki jumlah atom karbon lebih banyak maka titik didihnya lebih tinggi.
Zat Pencemar Air dan Akibat yang di Timbulkan
Air tersebut kondisinya belum tentu bersih, melainkan sudah tercampur dengan bermacam-macam kotoran bergantung pada daerah tempat sumber air itu berada dan pada daerah yang dilaluinya.
1. Sumber dan Macam Bahan Pencemar Air
Pencemaran air terjadi apabila dalam air terdapat berbagai macam zat atau kondisi (misal Panas) yang dapat menurunkan standar kualitas air yang telah ditentukan, sehingga tidak dapat digunakan untuk kebutuhan tertentu.
Suatu sumber air dikatakan tercemar tidak hanya karena tercampur dengan bahan pencemar, akan tetapi apabila air tersebut tidak sesuai dengan kebutuhan tertentu, Sebagai contoh suatu sumber air yang mengandung logam berat atau mengandung bakteri penyakit masih dapat digunakan untuk kebutuhan industri atau sebagai pembangkit tenaga listrik, akan tetapi tidak dapat digunakan untuk kebutuhan rumah tangga (keperluan air minum, memasak, mandi dan mencuci).
Sumber penyebab terjadinya Pencemaran Air
Ada beberapa penyebab terjadinya pencemaran air antara lain apabila air terkontaminasi dengan bahan pencemar air seperti sampah rumah tangga, sampah lembah industri, sisa-sisa pupuk atau pestisida dari daerah pertanian, limbah rumah sakit, limbah kotoran ternak, partikulat-partikulat padat hasil kebakaran hutan dan gunung berapi yang meletus atau endapan hasil erosi tempat-tempat yang dilaluinya.
Bahan Pencemar air
Pada dasarnya Bahan Pencemar Air dapat dikelompokkan menjadi:
a) Sampah yang dalam proses penguraiannya memerlukan oksigen yaitu sampah yang mengandung senyawa organik, misalnya sampah industri makanan, sampah industri gula tebu, sampah rumah tangga (sisa-sisa makanan), kotoran manusia dan kotoran hewan, tumbuh-tumbuhan dan hewan yang mati.
Untuk proses penguraian sampah-sampah tersebut memerlukan banyak oksigen, sehingga apabila sampah-sampah tersbut terdapat dalam air, maka perairan (sumber air) tersebut akan kekurangan oksigen, ikan-ikan dan organisme dalam air akan mati kekurangan oksigen. Selain itu proses penguraian sampah yang mengandung protein (hewani/nabati) akan menghasilkan gas H2S yang berbau busuk, sehingga air tidak layak untuk diminum atau untuk mandi.
C, H, S, N, + O2 —–> CO2 + H2O + H2S + NO + NO2
Senyawa organik
b) Bahan pencemar penyebab terjadinya penyakit, yaitu bahan pencemar yang mengandung virus dan bakteri misal bakteri coli yang dapat menyebabkan penyakit saluran pencernaan (disentri, kolera, diare, types) atau penyakit kulit. Bahan pencemar ini berasal dari limbah rumah tangga, limbah rumah sakit atau dari kotoran hewan/manusia.
c) Bahan pencemar senyawa anorganik/mineral misalnya logam-logam berat seperti merkuri (Hg), kadmium (Cd), Timah hitam (pb), tembaga (Cu), garam-garam anorganik. Bahan pencemar berupa logam-logam berat yang masuk ke dalam tubuh biasanya melalui makanan dan dapat tertimbun dalam organ-organ tubuh seperti ginjal, hati, limpa saluran pencernaan lainnya sehingga mengganggu fungsi organ tubuh tersebut.
d) Bahan pencemar organik yang tidak dapat diuraikan oleh mikroorganisme yaitu senyawa organik berasal dari pestisida, herbisida, polimer seperti plastik, deterjen, serat sintetis, limbah industri dan limbah minyak. Bahan pencemar ini tidak dapat dimusnahkan oleh mikroorganisme, sehingga akan menggunung dimana-mana dan dapat mengganggu kehidupan dan kesejahteraan makhluk hidup.
e) Bahan pencemar berupa makanan tumbuh-tumbuhan seperti senyawa nitrat, senyawa fosfat dapat menyebabkan tumbuhnya alga (ganggang) dengan pesat sehingga menutupi permukaan air. Selain itu akan mengganggu ekosistem air, mematikan ikan dan organisme dalam air, karena kadar oksigen dan sinar matahari berkurang. Hal ini disebabkan oksigen dan sinar matahari yang diperlukan organisme dalam air (kehidupan akuatik) terhalangi dan tidak dapat masuk ke dalam air.
f) Bahan pencemar berupa zat radioaktif, dapat menyebabkan penyakit kanker, merusak sel dan jaringan tubuh lainnya. Bahan pencemar ini berasal dari limbah PLTN dan dari percobaan-percobaan nuklir lainnya.
g) Bahan pencemar berupa endapan/sedimen seperti tanah dan lumpur akibat erosi pada tepi sungai atau partikulat-partikulat padat/lahar yang disemburkan oleh gunung berapi yang meletus, menyebabkan air menjadi keruh, masuknya sinar matahari berkurang, dan air kurang mampu mengasimilasi sampah.
h) Bahan pencemar berupa kondisi (misalnya panas), berasal dari limbah pembangkit tenaga listrik atau limbah industri yang menggunakan air sebagai pendingin. Bahan pencemar panas ini menyebabkan suhu air meningkat tidak sesuai untuk kehidupan akuatik (organisme, ikan dan tanaman dalam air). Tanaman, ikan dan organisme yang mati ini akan terurai menjadi senyawa-senyawa organik. Untuk proses penguraian senyawa organik ini memerlukan oksigen, sehingga terjadi penurunan kadar oksigen dalam air.
Secara garis besar bahan pencemar air tersebut di atas dapat dikelompokkan menjadi:
a) Bahan pencemar organik, baik yang dapat mengalami penguraian oleh mikroorganisme maupun yang tidak dapat mengalami penguraian.
b) Bahan pencemar anorganik, dapat berupa logam-logam berat, mineral (garam-garam anorganik seperti sulfat, fosfat, halogenida, nitrat)
c) Bahan pencemar berupa sedimen/endapan tanah atau lumpur.
d) Bahan pencemar berupa zat radioaktif
e) Bahan pencemar berupa panas
Parameter dan standar kualitas air
Telah Anda ketahui bahwa sumber air dikatakan tercemar apabila mengandung bahan pencemar yang dapat mengganggu kesejahteraan makhluk hidup (hewan, manusia, tumbuh-tumbuhan) dan lingkungan. Akan tetapi air yang mengandung bahan pencemar tertentu dikatakan tercemar untuk keperluan tertentu, misalnya untuk keperluan rumah tangga belum tentu dapat dikatakan tercemar untuk keperluan lain.
Dengan demikian standar kualitas air untuk setiap keperluan akan berbeda, bergantung pada penggunaan air tersebut, untuk keperluan rumah tangga berbeda dengan standar kualitas air untuk keperluan lain seperti untuk keperluan pertanian, irigasi, pembangkit tenaga listrik dan keperluan industri. Dengan demikian tentunya parameter yang digunakan pun akan berbeda pula.
Sesuai dengan bahan pencemar yang terdapat dalam sumber air, maka parameter yang biasa digunakan untuk mengetahui standar kualitas air pun berdasarkan pada bahan pencemar yang mungkin ada, antara lain dapat dilihat dari:
a) warna, bau, dan/atau rasa dari air.
b) Sifat-sifat senyawa anorganik (pH, daya hantar spesifik, daya larut oksigen, daya larut garam-garam dan adanya logam-logam berat).
c) Adanya senyawa-senyawa organik yang terdapat dalam sumber air (misal CHCl3, fenol, pestisida, hidrokarbon).
d) Keradioaktifan misal sinar ß.
e) Sifat bakteriologi (misal bakteri coli, kolera, disentri, typhus dan masih banyak lagi).
2. Pengaruh Pencemaran Air terhadap Kehidupan Akuatik, Hewan dan Tumbuh-tumbuhan Darat dan Tubuh Manusia
Pengaruh pencemaran air terhadap kehidupan akuatik
Banyak macam makhluk yang hidup dalam air antara lain bermacam-macam ikan, buaya, penyu, katak, mikroorganisme, ganggang, tanaman air dan lumut. Kesemuanya termasuk dalam kehidupan akuatik.
Apabila sumber air tempat kehidupan akuatik tercemar, maka siklus makanan dalam air terganggu dan ekosistem air/kehidupan akuatik akan terganggu pula. Misal organisme yang kecil/lemah seperti plankton banyak yang mati karena banyak keracunan bahan tercemar, ikan-ikan kecil pemakan plankton banyak yang mati karena kekurangan makanan, demikian pula ikan-ikan yang lebih besar pemakan ikan-ikan kecil bila kekurangan makanan akan mati.
Kehidupan akuatik dapat pula terganggu karena:
a) Perairan kekurangan kadar oksigen atau sinar matahari yang disebabkan air menjadi keruh oleh pencemaran tanah/lumpur.
b) Permukaan perairan tertutup oleh lapisan bahan pencemar minyak atau busa deterjen, sehingga sinar matahari dan oksigen yang diperlukan untuk kehidupan akuatik tidak dapat menembus permukaan air masuk ke dalam air.
c) Berkurang/habisnya kadar oksigen dalam proses pengairan bahan pencemar senyawa organik.
d) Permukaan air tertutup oleh tanaman air seperti enceng gondo sebagai bahan pencemar yang tumbuh subur oleh adanya bahan pencemar berupa makanan penyubur tanaman seperti senyawa-senyawa fosfat, nitrat.
e) Peningkatan suhu air karena adanya bahan pencemar panas dari industri-industri yang menggunakan air sebagai pendingin, atau sebagai air bangunan dari pembangkit tenaga listrik.
3. Pengaruh pencemaran air terhadap hewan, tumbuh-tumbuhan dan tubuh manusia
Diantara sekian banyak bahan pencemar air ada yang beracun dan berbahaya dan dapat menyebabkan kematian. Telah anda pelajari bahwa bahan pencemar air antara lain ada yang berupa logam-logam berat seperti arsen (As), kadmium (Cd), berilium (Be), Boron (B), tembaga (Cu), fluor (F), timbal (Pb), air raksa (Hg), selenium (Se), seng (Zn).
Ada juga yang berupa oksida-oksida karbon (CO dan CO2), oksidaoksida nitrogen (NO dan NO2), oksida-oksida belerang (SO2 dan SO3), H2S, asam sianida (HCN), senyawa/ion klorida, partikulat padat seperti asbes, tanah/lumpur, senyawa hidrokarbon seperti metana, dan heksana. Bahan-bahan pencemar ini terdapat dalam air, ada yang berupa larutan ada pula yang berupa partikulat-partikulat, yang masuk melalui bahan makanan yang terbawa ke dalam pencernaan atau melalui kulit.
Bahan pencemar unsur-unsur di atas terdapat dalam air di alam ataupun dalam air limbah. Walaupun unsur-unsur diatas dalam jumlah kecil esensial/diperlukan dalam makanan hewan maupun tumbuh-tumbuhan, akan tetapi apabila jumlahnya banyak akan bersifat racun, contoh tembaga (Cu), seng (Zn) dan selenium (Se) dan molibdium esensial untuk tanaman tetapi bersifat racun untuk hewan.
Air merupakan kebutuhan primer bagi kehidupan di muka bumi terutama bagi manusia. Oleh karena itu apabila air yang akan digunakan mengandung bahan pencemar akan mengganggu kesehatan manusia, menyebabkan keracunan bahkan sangat berbahaya karena dapat menyebabkan kematian apabila bahan pencemar itu tersebut menumpuk dalam jaringan tubuh manusia. Bahan pencemar yang menumpuk dalam jaringan organ tubuh dapat meracuni organ tubuh tersebut, sehingga organ tubuh tidak dapat berfungsi lagi dan dapat menyebabkan kesehatan terganggu bahkan dapat sampai meninggal.
Selain bahan pencemar air seperti tersebut di atas ada juga bahan pencemar berupa bibit penyakit (bakteri/virus) misalnya bakteri coli, disentri, kolera, typhus, para typhus, lever, diare dan bermacam-macam penyakit kulit. Bahan pencemar ini terbawa air permukaan seperti air sungai dari buangan air rumah tangga, air buangan rumah sakit, yang membawa kotoran manusia atau kotoran hewan.
4. Penanggulangan terhadap terjadinya pencemaran air dan pengolahan limbah
Penanggulangan terjadinya pencemaran air
Untuk mencegah agar tidak terjadi pencemaran air, dalam aktivitas kita dalam memenuhi kebutuhan hidup hendaknya tidak menambah terjadinya bahan pencemar antara lain tidak membuang sampah rumah tangga, sampah rumah sakit, sampah/limbah industri secara sembarangan, tidak membuang ke dalam air sungai, danau ataupun ke dalam selokan.
Tidak menggunakan pupuk dan pestisida secara berlebihan, karena sisa pupuk dan pestisida akan mencemari air di lingkungan tanah pertanian. Tidak menggunakan deterjen fosfat, karena senyawa fosfat merupakan makanan bagi tanaman air seperti enceng gondok yang dapat menyebabkan terjadinya pencemaran air.
Pencemaran air yang telah terjadi secara alami misalnya adanya jumlah logam-logam berat yang masuk dan menumpuk dalam tubuh manusia, logam berat ini dapat meracuni organ tubuh melalui pencernaan karena tubuh memakan tumbuh-tumbuhan yang mengandung logam berat meskipun diperlukan dalam jumlah kecil.
Penumpukan logam-logam berat ini terjadi dalam tumbuh-tumbuhan karena terkontaminasi oleh limbah industri. Untuk menanggulangi agar tidak terjadi penumpukan logam-logam berat, maka limbah industri hendaknya dilakukan pengolahan sebelum dibuang ke lingkungan. Proses pencegahan terjadinya pencemaran lebih baik daripada proses penanggulangan terhadap pencemaran yang telah terjadi.
Pengolahan limbah
Limbah industri sebelum dibuang ke tempat pembuangan, dialirkan ke sungai atau selokan hendaknya dikumpulkan di suatu tempat yang disediakan, kemudian diolah, agar bila terpaksa harus dibuang ke sungai tidak menyebabkan terjadinya pencemaran air. Bahkan kalau dapat setelah diolah tidak dibuang ke sungai melainkan dapat digunakan lagi untuk keperluan industri sendiri.
Sampah padat dari rumah tangga berupa plastik atau serat sintetis yang tidak dapat diuraikan oleh mikroorganisme dipisahkan, kemudian diolah menjadi bahan lain yang berguna, misalnya dapat diolah menjadi keset. Sampah organik yang dapat diuraikan oleh mikroorganisme dikubur dalam lubang tanah, kemudian kalau sudah membusuk dapat digunakan sebagai pupuk.
Kromatografi Gas
Dalam kromatografi gas, fase yang bergerak (atau "mobile phase") adalah sebuah operator gas, yang biasanya gas murni seperti helium atau yang tidak reactive seperti gas nitrogen. Stationary atau fasa diam merupakan tahap mikroskopis lapisan cair atau polimer yang mendukung gas murni, di dalam bagian dari sistem pipa-pipa kaca atau logam yang disebut kolom. Instrumen yang digunakan untuk melakukan kromatografi gas disebut gas chromatograph (atau "aerograph", "gas pemisah").
Compounds gas yang sedang dianalisis berinteraksi dengan dinding kolom yang dilapisi dengan berbagai tahapan stationary. Ini menyebabkan setiap kompleks ke elute di waktu yang berbeda, yang dikenal sebagai ingatan waktu yang kompleks. Perbandingan dari ingatan kali yang memberikan kegunaan analisis GC-nya.
Kromatografi gas yang pada prinsipnya sama dengan kromatografi kolom (serta yang lainnya bentuk kromatografi, seperti HPLC, TLC), tapi memiliki beberapa perbedaan penting. Pertama, proses memisahkan compounds dalam campuran dilakukan antara stationary fase cair dan gas fase bergerak, sedangkan pada kromatografi kolom yang seimbang adalah tahap yang solid dan bergerak adalah fase cair. (Jadi, nama lengkap prosedur adalah "kromatografi gas-cair", merujuk ke ponsel dan stationary tahapan, masing-masing.) Kedua, melalui kolom yang lolos tahap gas terletak di sebuah oven dimana temperatur gas yang dapat dikontrol, sedangkan kromatografi kolom (biasanya) tidak memiliki kontrol seperti suhu. Ketiga, konsentrasi yang majemuk dalam fase gas adalah hanya salah satu fungsi dari tekanan uap dari gas.
Kromatografi gas juga mirip dengan pecahan penyulingan, karena kedua proses memisahkan komponen dari campuran terutama berdasarkan titik didih (atau tekanan uap) perbedaan. Namun, pecahan penyulingan biasanya digunakan untuk memisahkan komponen campuran pada skala besar, sedangkan GC dapat digunakan pada skala yang lebih kecil (yakni microscale).
Kromatografi gas terkadang juga dikenal sebagai uap-tahap kromatografi (VPC), atau gas-cair kromatografi partisi (GLPC). Alternatif nama ini, serta masing-masing singkatan, sering ditemukan dalam literatur ilmiah. Strictly speaking, GLPC adalah istilah yang paling benar, dan dengan demikian banyak disukai oleh penulis.
Rumus Kimia Asam Amino
NH2
|
R-CH-COOH
Suatu asam amino mengandung gugus amina yang bersifat basa dan gugus karboksil yang bersifat asam dalam molekul yang sama. Suatu asam amino yang mengalami reaksi asam basa internal, yang menghasilkan suatu ion dipolar yang disebut sebagai switter ion. Karena terjadinya muatan ion, suatu asam amino mempunyai banyak sifat garam. Pxa suatu asam amino bukanlah Pxa dari gugus -COOH melainkan dari gugus -NH3 dan sebaliknya(Fessenden, 1989)
Asam amino tidak selalu bersifat seperti senyawa-senyawa organik, misalnya titik lelehnya diatas 200*C, sedangkan kebanyakan senyawa organik dengan bobot molekul sekitar itu berupa cairan pada temperatur kamar. Asam amino larut dalam air dan pelarut polar lain, tetapi tidak larut dalam pelarut non-polar, seperti dietil eter atau benzena. Asam amino mempunyai momendipol yang besar dan juga mereka kurang bersifat asam dibandingkan sebagian besar asam karboksilat, dan kurang bisa dibandingkan dengan sebagian besar amina(Fessenden, 1990).
Asam amino bersifat antara asam lemah dan basa lemah, ia akan terionisasi diantara asam dan basa dalam larutan berair yang disebut amfoterik, sebagai contoh adalah glisin. Senyawa-senyawa amfoterik akan bereaksi dengan asam ataupun basa dan membentuk garam(Routh, 1969).
Dua asam amino berikatan melalui suatu ikatan peptida dengan melepas sebuah molekul air. Reaksi kesetimbangan ini cenderung untuk berjalan kehidrolisis daripada sintesis. Gugus karboksil suatu asam amino berikatan dengan gugus amino dari asam amino lain yang menghasilkan peptida dengan melepas molekul air(Winarno, 1992).
Suatu ikatan peptida mempunyai ikatan rangkaian yang disebabkan oleh tumpang tindih orbital p dari gugus karbonil dengan pasangan elektron yang terdiri dari nitrogen. Suatu peptida adalah suatu amida yang dibentuk dari dua asam amino atau lebih. Ikatan amida antara gugus alfa amino dari suatu asam amino dan gugus karboksil dari asam amino lain adalah ikatan peptida(Fessenden, 1989).
Asam amino dapat berperan sebagai asam atau basa, jika suatu kristal asam amino, misalnya alanin dilarutkan dalam air, molekul ini menjadi dipolar yang dapat berperan sebagai asam atau bersifat basa(Lehninger, 1993).
Asam amino tidak hanya berperan sebagai bahan bangunan dari protein, tapi juga merupakan pelopor kimia bagi banyak senyawa, misalnya glisin diperlukan untuk biosintesis gugus dari hemoglobin. Triptofan merupakan pelopor dan suatu famili zat-zat penting dalam biokimia sistem syaraf. Tirosin merupakan materi penghubung bagi biosintesa dari pigmen kulit. Melanin merupakan biosintesa penghubung yang mengandung nitrogen(Neal, 1971).
Kelarutan asam amino adalah larut dalam pelarut polar seperti air dan etanol, tetapi tidak larut dalam pelarut non-polar, seperti benzena, heksana dan eter. Titik leburnya yang relatif tinggi (diatas 200*C) menyatakan adanya gugus-gugus yang bermuatan yaitu energi tingi yang diperlukan untuk memecahkan ionik yang mempertahankan kisi-kisi kristal(Martin, 1987).
Asam amino yang sederhana, glisin dapat digunakan sebagai contoh asam amino atau protein sebagai buffer. Ketika glisin didalam larutan dititrasi dengan asam atau basa terjadi pertukaran molekul dari bentuk zwitter ke bentuk dissosiasi pada gugus asam amino atau karboksil(Routh, 1969).
H-CH(NH3)-COOH <====> H+ + H-CH(NH3)-COO- + -OH <====> H-CH(NH2)-COO- + H2O
lart.asam(pH=2,4) zwitter ion(pH=6,0) lart.basa
Dalam titrasi asam amino, asam amino bertindak sebagai buffer dalam daerah dan cairan tubuh lain yang mempunyai ion dipolar memberikan dua disosiasi ketika bereaksi dengan asam atau basa. Persamaan Hendersen Hassel Bakk, untuk buffer sederhana yang menunjukkan konstanta disosiasi atau Pka sebagai pH pada konsentrasi sama dari gambar dan bentuk buffer asam adalah dituliskan sebagai berkut(Routh, 1969):
pH = Pka + Log garam/asam
= Pk + Log 1/1
= Pk
Sifat-sifat khusus asam amino antara lain, asam amino tidak menyerap cahaya tampah/visible. Dengan pengecualian asam amino aromatik triptofan, tyrosin, fenil alanin dan histidin, tidak menyerap sinar UV yang mempunyai panjang gelombang 240nm. Sebagian besar yang mempunyai panjang gelombang diatas 240nm penyerapan UV oleh protein disebabkan kandungan triptofannya(Martin, 1987).
Pustaka:
- Fessenden, R.J and Fessenden, J.S, 1989, KIMIA ORGANIK jilid 2, Erlangga, Jakarta
- Fessenden, R.J and Fessenden, J.S, 1990, KIMIA ORGANIK, Erlangga, Jakarta
- Lehninger, A.L, 1993, DASAR_DASAR BIOKIMIA jilid 1, Erlangga, Jakarta
- Martin, 1987, HARPERS REVIEW of BIOCHEMISTRY edisi 20, penerjemah: lan,D.EGC, Jakarta
Neal, A, 1971, CHEMISTRY AND BIOCHEMISTRY, MC, Grow Hill Book Company, New York
- Routh, J.I, 1969, ESSENTIAL of GENERAL ORGANIC and BIOCHEMISTRY, W.B.Sounders Company, Philadelphia
- Winarno, F.G, 1997, KIMIA PANGAN dan GIZI, Gramedia Pustaka Utama, Jakarta
Penemuan Senyawa Baru Oleh dosen ITB
Pidato pertama yang berjudul “Keanekaragaman Hayati sebagai Sumber Keanekaragaman Molekul yang Unik dan Potensial untuk Bioindustri” disampaikan oleh Prof. Dr. Euis Holiston Hakim, M.Si., yang mendapat gelar guru besar Program Studi Kimia FMIPA sejak tahun 2004. Lulusan sarjana dan pascasarjana ITB ini memaparkan hasil penelitian-penelitian terbarunya dalam tim yang tergabung pada Kelompok Keilmuan Kimia Organik Bahan Alam. Penelitan beliau berpusat pada kemotaksonomi pada tiga famili tumbuhan yaitu Lauraceae (‘medang’), Moraceae (nangka-nangkaan) dan Dipterocarpaceae (‘meranti/kamper/keruing). Penelitan tersebut menghasilkan banyak senyawa kimia baru dengan nama-nama trivial antara lain “itebein” (alkaloid jenis fenantren), “indonesiol”, “kriptokarion” dari tumbuhan ‘Crytocarya’, “litseakasifolid dari ‘Litsea casifolia’, “artoindonesianin” dari ‘Artokarpus’, “diptoindonesin’ dari tumbuhan ‘Dipterocarpaceae’. Senyawa-senyawa kimia baru ini memiliki prospek besar untuk ilmu pengetahuan Indonesia dan industri yang berbasis biomassa. Penemuan senyawa-senyawa baru yang dimulai sejak tahun 1990 ini membuktikan keunggulan dari keanekaragaman hayati Indonesia dan besarnya potensial bioaktivitas untuk dikembangkan lebih lanjut dalam industri farmasi.
Pidato kedua disampaikan oleh Prof. Tjandra Setiadi, guru besar dari Prgram Studi Teknik Kimia FTI sejak April 2006 lalu. Judul pidato beliau adalah “Peranan Teknik Bioproses dalam Mewujudkan Masyarakat yang Berkelanjutan.” Lulusan sarjana Teknik Kimia ITB tahun 1980 ini mulai fokus pada bidang bioproses sejak beliau mengerjakan disertasi program doktornya di University of Strathclyde, Glasgow. Teknik bioproses, menurut beliau, mempunyai potensi besar dalam menunjang kelestarian lingkungan dalam masyarakat yang berkelanjutan. Penelitian yang beliau garap baru-baru ini pun menggunakan teknik-teknik bioproses seperti bioreaktor membran, produksi plastik bidegradabel (polihidrosialkanoat, PHA), penghilangan warna dengan teknologi ramah lingkungan, penerapan proses anaerobik bagi air limbah industri dan beberapa penelitian lain yang masih berjalan. Teknik bioproses bekerja pada garis batas antara biologi dan ilmu teknik melalui konversi materi biologi menjadi bentuk lain yang diperlukan oleh umat manusia. Teknik bioproses berperan sangat penting dalam industri bioteknologi yang tidak merusak lingkungan dan meningkatkan efisiensi energi. Industri yang berbasis biomassa ini dapat menunjang keberlanjutan ekonomi, sosial dan lingkungan menuju kehidupan masyarakat yang lebih baik. Menurut salah satu penerima lencana satya karya tahun 2006 ini, teknik bioproses perlu dikembangkan lebih lanjut dan melibatkan kerjasama antar disiplin ilmu, terutama dalam lingkup ITB